Corrosión en tubería
sumergida en agua de mar
 |
Corrosión en tubería
sumergida en agua de mar |
La corrosión es una de las causas más frecuentes de roturas de estructuras metálicas en contacto con electrolitos (aguas y suelos); por tal motivo, a nivel mundial se dedican grandes esfuerzos destinados a evitar estos daños, traduciéndose en costos importantes para las industrias y los estados.
Un estudio realizado recientemente en los Estados Unidos determino que el costo directo total en relación a la corrosión es de u$s 279 billones por año, lo que representa el 3,2 % del GDP (gross domestic product). Para conocer el gasto total relacionado con los procesos de corrosión, además de los costos directos deben tenerse en cuenta los indirectos, que, conservadoramente, han sido estimados en un monto similar al de los directos. Esto significa que el costo total para ese país debido a procesos de corrosión es de aproximadamente el 6 % del GDP.
Nociones de la Protección Catódica
En la naturaleza, los metales se hallan en forma combinada con otros elementos formando compuestos químicos. Para transformar el mineral en metal utilizable se emplean varios procesos mecánicos, químicos y eléctricos. Más allá del proceso utilizado, el metal absorbe energía durante la transformación y la cantidad de energía absorbida por el metal durante el proceso de refinación determinara luego la tendencia de este a volver a su estado natural (estado activo del metal). Cuanto mayor sea la energía, más activo será el metal y mayor tendencia tendrá a corroerse.
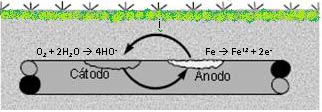 |
Celda de corrosión en la superficie de una tubería. |
Se puede decir entonces que la corrosión es el resultado de una reacción electroquímica impulsada por una diferencia de potencial donde el metal pasa a un estado combinado mediante una reacción de oxidación ocurrida en el ánodo. La reacción anódica para el Hierro es:
Fe à Fe+2 + 2e-
Esta reacción libera electrones, los cuales son consumidos en otra área del metal por una reacción catódica o de reducción, las cuales pueden ser dependiendo el medio:
2H+ + 2e- à H2 (g) (medio ácido)
O2 + 2H2O à 4HO- (medio neutral)
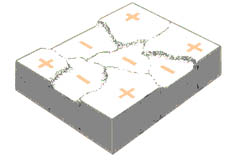 |
Representación de los sitios anódicos y
catódicos en la superficie de un metal. |
En el caso de la corrosión uniforme, existen muchos sitios anódicos y catódicos microscópicos sobre la superficie de la estructura metálica, pero para que ocurra el proceso de deterioro en el metal es necesaria además la presencia de los siguientes elementos de manera tal que se forme una celda de corrosión:
- Una zona anódica
- Una zona catódica
- Un electrolito
- Una buena conexión eléctrica
Si alguno de estos elementos no está presente, no se puede formar la celda de corrosión, por lo que el proceso de deterioro del metal no tiene lugar, ergo será sobre estos elementos con los cual se trabaje para eliminar o mitigar la corrosión.
La diferencia de potencial entre la zona anódica y la catódica, fuerza impulsora de la corrosión, se puede dar por una gran variedad de factores exógenos y endógenos. Entre los exógenos están la diferencia de temperaturas, diferencias en el electrolito, diferencia en la aireación, etc.; y entre los endógenos o propios del material pueden nombrarse las diferencias en los esfuerzos aplicados al material, diferencias en cuanto a la concentración de aleantes entre otros.
 |
| Ánodos de Magnesio desnudos y con backfill |
El principio de la protección catódica como se dijo antes, actúa sobre el concepto de reducir a cero la diferencia de potencial entre los sitios anódicos y catódicos, obteniendo como resultado cero corriente de corrosión. Esto puede lograrse imprimiendo corriente hacia la estructura desde un electrodo externo y polarizando los sitios catódicos en dirección electronegativa. Hoy en día se utilizan 2 formas para imprimir corriente a una estructura para su protección:
- Mediante el uso de ánodos galvánicos o de sacrificio, o
- Mediante la impresión de corriente desde una fuente externa de corriente continua
El sistema que utiliza ánodos galvánicos emplea aleaciones de alto potencial de oxidación (Zn, Mg, Al) y son eléctricamente conectados a la estructura a proteger. La diferencia natural de potencial entre el ánodo y el acero, será la fuerza impulsora del flujo de corriente que se oponga a la corriente de corrosión.
Los sistemas de protección catódica por corriente impresa, también utilizan ánodos pero, a diferencia de los galvánicos, estos son inertes o de muy baja disolución, y usan una fuente externa de corriente continua como fuerza impulsora de la corriente de protección.
Las ventajas y usos de la Protección Catódica
La principal ventaja de la protección catódica por sobre otras formas de tratamientos anticorrosivos, radica en que simplemente es aplicada mediante la formación de un circuito de corriente continua, el cual puede ser monitoreado en su efectividad, constantemente. La protección catódica puede, en principio, ser aplicada a cualquier estructura que se encuentre en contacto con un electrolito, inclusive concreto pero por lo general es aplicada a estructuras con recubrimiento como una forma de prevenir el daño en defectos del recubrimiento o en zonas de difícil acceso. En la práctica, sus principales usos son para proteger estructuras que se encuentran enterradas o sumergidas tales como:
- Tuberías y tanques enterrados
- Bases de tanques de almacenaje
- Pilares de fundación
- Plataformas off-shore, estructuras flotantes o sumergidas de acero
También se utiliza para proteger superficies internas de:
- Tuberías de gran diámetro
- Tanques de almacenamiento (agua o aceites)
- Sistemas de circulación de agua
A modo de conclusión se puede decir que la aplicación de protección catódica genera provechosos resultados como un aumento de la vida útil de los activos metálicos, disminución de los costos de mantenimiento asociados con reparaciones prematuras y por penalizaciones ambientales, eliminación/disminución de pérdidas operativas, financieras y de imagen, al mantener la integridad del activo metálico, ya que mediante el control de la corrosión, se reducen las posibilidades de interrupción de la continuidad operacional de los activos por roturas causadas por corrosión externa. Todas estas ventajas hacen que la hora de evaluar un proyecto de protección catódica en cuanto a su viabilidad financiera el resultado obtenido sea un diferencial positivo de capital, lo que significa que no solo estamos cuidando nuestro activo sino que también estamos aumentándolo.
Ing. Químico Julian Reynoso
NACE Corrosion Technician
| volver al sumario | |