 Anteriormente se mostró cuales eran los fundamentos básicos de la protección catódica, como así también las características principales de los electrodos de referencia, herramienta fundamental para la medición de potenciales. En la presentación de hoy se tratara del fenómeno de polarización que tiene lugar en una celda de corrosión cuando se conectan eléctricamente dos metales con distintos potenciales de oxidación. Anteriormente se mostró cuales eran los fundamentos básicos de la protección catódica, como así también las características principales de los electrodos de referencia, herramienta fundamental para la medición de potenciales. En la presentación de hoy se tratara del fenómeno de polarización que tiene lugar en una celda de corrosión cuando se conectan eléctricamente dos metales con distintos potenciales de oxidación.
Cuando se conectan dos metales con distintos potenciales de oxidación a través de un conductor y a medida que el flujo de corriente continúa a lo largo del tiempo, tiene lugar la polarización en el ánodo y en el cátodo. La polarización disminuye la diferencia de potencial entre las zonas anódicas y catódicas y, según la Ley de Ohm, la corriente, I, disminuye y la velocidad de corrosión disminuye hasta alcanzar un equilibrio entre los efectos de polarización y despolarización. Entre los despolarizantes se incluyen:
- Oxígeno disuelto
- Actividad microbiológica
- Flujo de agua
La polarización siempre ocurre en dirección opuesta al flujo de corriente que la causa. Cuando el ánodo y el cátodo de una celda de corrosión están conectados, la corriente circula entre ellos. Esta corriente hará que el potencial del ánodo se acerque al del cátodo. Además, el potencial del cátodo se acercará al del ánodo.
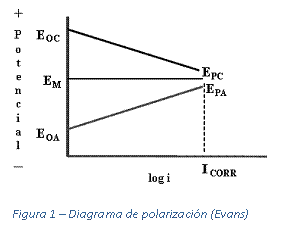 A medida que la resistencia del paso electrónico y electrolítico se aproxima a cero, la diferencia de potencial entre los electrodos polarizados también se aproxima a cero, y ambos electrodos alcanzan un potencial mixto estable (EM). Sin embargo, en la realidad siempre habrá resistencia en los pasos de la corriente, así que el potencial mixto estará en algún punto entre los potenciales polarizados de los dos electrodos. La diferencia entre los potenciales polarizados del ánodo y del cátodo es la fuerza impulsora de la celda de corrosión. En esta condición de estado estacionario, la corriente se define como corriente de corrosión (ICORR) del sistema. La Figura 1 ilustra el concepto de polarización. Estos diagramas se conocen como diagramas de Evans y se confeccionan inyectando una corriente externa, I, que circule entre el metal a medir (llamado electrodo operativo) y otro electrodo (el contra-electrodo), mientras se monitorea el potencial (E) del electrodo operativo respecto a un electrodo de referencia. Los potenciales de electrodo previos al flujo de corriente se conocen como potenciales a circuito abierto. Estos potenciales (EOC y EOA) son los potenciales del cátodo y del ánodo cuando la corriente de corrosión es igual a cero. EPA es el potencial polarizado del ánodo; EPC es el potencial polarizado del cátodo. ICORR es la corriente de corrosión de la celda de corrosión. A medida que se aumenta la corriente, el valor de E cambia, ya sea en sentido anódico o catódico, dependiendo de su dirección, es decir, EOC →EPC, EOA→EPA. EM es el potencial mixto (el potencial que realmente puede medirse) de la celda de corrosión combinada a ICORR. A medida que la resistencia del paso electrónico y electrolítico se aproxima a cero, la diferencia de potencial entre los electrodos polarizados también se aproxima a cero, y ambos electrodos alcanzan un potencial mixto estable (EM). Sin embargo, en la realidad siempre habrá resistencia en los pasos de la corriente, así que el potencial mixto estará en algún punto entre los potenciales polarizados de los dos electrodos. La diferencia entre los potenciales polarizados del ánodo y del cátodo es la fuerza impulsora de la celda de corrosión. En esta condición de estado estacionario, la corriente se define como corriente de corrosión (ICORR) del sistema. La Figura 1 ilustra el concepto de polarización. Estos diagramas se conocen como diagramas de Evans y se confeccionan inyectando una corriente externa, I, que circule entre el metal a medir (llamado electrodo operativo) y otro electrodo (el contra-electrodo), mientras se monitorea el potencial (E) del electrodo operativo respecto a un electrodo de referencia. Los potenciales de electrodo previos al flujo de corriente se conocen como potenciales a circuito abierto. Estos potenciales (EOC y EOA) son los potenciales del cátodo y del ánodo cuando la corriente de corrosión es igual a cero. EPA es el potencial polarizado del ánodo; EPC es el potencial polarizado del cátodo. ICORR es la corriente de corrosión de la celda de corrosión. A medida que se aumenta la corriente, el valor de E cambia, ya sea en sentido anódico o catódico, dependiendo de su dirección, es decir, EOC →EPC, EOA→EPA. EM es el potencial mixto (el potencial que realmente puede medirse) de la celda de corrosión combinada a ICORR.
Por lo general, la polarización se relaciona con el consumo de los reactivos y con la acumulación de productos de la reacción. Cualquier cosa que favorezca la acumulación de productos de reacción o el consumo de reactivos, aumentará la polarización. Consecuentemente, cualquier acción que remueva los productos de reacción o suministre reactivos, reducirá la polarización.
Hay dos tipos de polarización –por activación y por concentración.
Polarización por Activación
Es la que resulta como consecuencia de la existencia de una etapa de la reacción total conocida como la etapa determinante de la velocidad (rate determining step en cinética química o electroquímica), en la reacción que tiene lugar en la interfase electrodo/electrolito. Estas reacciones son las que tienen lugar una vez que todos los reactivos ya han alcanzado esta superficie de reacción, es decir cuando no hay retardo en la llegada de reactivos por un proceso difusional. La reacción de transferencia de carga involucra mover un electrón desde la superficie metálica al reactivo del lado del electrolito. Por ejemplo, considérese la evolución del gas hidrógeno en el cátodo. La velocidad a la cual los iones de hidrógeno se reducen a gas hidrógeno esta en función de diversos factores, incluyendo la velocidad de transferencia de electrones al ion hidrógeno en la superficie del metal. Por lo tanto la velocidad es inherente a esta reacción y depende del metal específico y de la temperatura del sistema. De hecho, hay grandes variaciones en la capacidad de los distintos metales para transferir electrones a los iones hidrógeno, y por lo tanto la velocidad de la evolución de hidrógeno para diferentes metales difiere considerablemente.
La polarización por activación predomina a menudo en los electrolitos en los que abundantes reactivos y/o productos propios de la reacción electroquímica son fácilmente provistos o bien removidos. En ácidos concentrados, predomina la polarización por activación.
Polarización por Concentración
Es el resultado de etapas en la reacción total que incluyen la difusión de reactantes hasta la superficie del electrodo o bien la eliminación de productos de la reacción. Cualquier cosa que provoque una disminución en la cantidad de reactantes disponibles o bien en el aumento de productos de la reacción, disminuye la velocidad de la reacción. Si la etapa más lenta de la reacción total de electrodo involucra el arribo de reactantes o la eliminación de productos de la reacción, se dice que la reacción se encuentra bajo control por polarización de concentración.
La polarización por concentración generalmente predomina en electrolitos en que la concentración de reactivos es baja, como en soluciones diluidas, o donde se acumulan productos de reacción, como en medios estáticos. La capacidad de los reactivos para alcanzar la superficie de reacción, y los productos de la reacción para alejarse de la misma, puede alcanzar una condición de densidad de corriente limite difusional. La polarización total de una estructura es la suma de las polarizaciones de activación y concentración.
Ing. Químico Julián Reynoso
ingjulianreynoso@gmail.com
| volver al sumario | |